Bioethiker über Datenschutz: „Nicht gleich das Messer schwingen“
Der Medizinrechtler und Bioethiker Nils Hoppe meint, wir sollten uns damit abfinden, dass es keinen allumfassenden Datenschutz gibt.
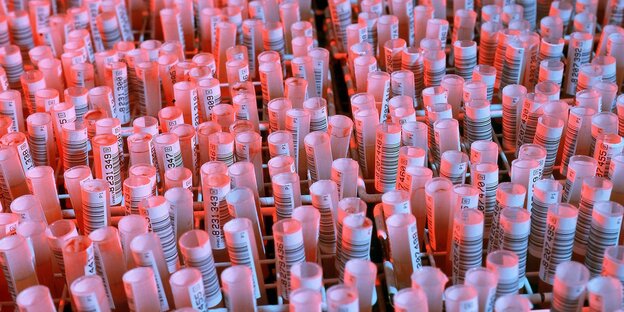
Begehrter Stoff für Genomforscher: Blutproben in Reagenzröhrchen. Foto: imago/Jochen Tack
taz: Herr Hoppe, die Menge an Gesundheitsdaten, die zu Forschungszwecken erhoben, gespeichert und verknüpft werden, verdoppelt sich in Deutschland jährlich. Selbst Menschen, die bereit sind, der Wissenschaft Angaben über sich und ihren Körper zu machen, haben Zweifel, ob ihre Daten sicher sind. Können Sie ihnen diese Sorge nehmen?
Nils Hoppe: Leider nicht. Es gibt das geflügelte Wort, dass man nichts in eine E-Mail schreiben sollte, das man nicht auf eine Postkarte schreiben würde. Das Gleiche gilt inzwischen doch für alle elektronisch verarbeiteten Daten. Wir müssen uns daran gewöhnen, dass wir hoch persönliche Daten online nicht hundertprozentig sicher bekommen.
Wie kann das sein?
Man hat lange versucht, über eine krude Anonymisierung der Daten Sicherheit herzustellen. Deswegen hat man, etwa bei den Volkszählungsdaten aus den 1980er Jahren, Geburtsangaben und regionale Daten von Erhebungsbögen entfernt. Bei den Gesundheitsdaten, über die wir jetzt sprechen, reicht das nicht mehr. Wenn die Datendichte über ein Individuum hoch genug ist, ist es irrelevant, ob Sie den Namen haben oder nicht. Es gibt dann genug andere individuelle Parameter, um die Person eindeutig zu identifizieren.
Klingt beunruhigend.
Finden Sie? Ich frage mich eher, ob es noch zeitgemäß ist, Menschen, die sich an wissenschaftlichen Studien beteiligen, eine hohe Datensicherheit zu versprechen.
Was sollte daran anachronistisch sein?
Öffentlich betriebene Gesundheitsforschung ist ein extrem hohes gesellschaftliches Ziel. Da lohnt es sich, eine Güterabwägung durchzuführen. Vielleicht muss der individuelle Datenschutz mitunter hintenanstehen, weil sonst die Forschung und sogar die klinische Versorgung behindert würden – und gerade das wäre ja ganz und gar nicht im Interesse der Patienten.
Nils Hoppe

Foto: privat
ist Professor für Biotechnologie- und Medizinrecht an der Leibniz-Universität in Hannover. Der 37-Jährige ist Mitbegründer und Direktor des Centre for Ethics and Law in the Life Sciences Hannover (CELLS).
Wieso?
Je mehr Informationen, desto höher die Patientensicherheit: Wir können auf diese Weise etwa verhindern, dass Ärzte in identischen Krankheitsfällen zweimal die falsche Entscheidung treffen. Oder Untersuchungen unnötigerweise doppelt durchführen. Das gelingt aber nur, indem wir Daten sowohl verknüpfen als auch auf die Probanden zurückgreifen können.
Warum ist die Erreichbarkeit der Probanden wichtig?
Angenommen, ich habe während eines Forschungsprojekts einen Zufallsbefund erhoben, den ich mitteilen möchte – nur, leider kann ich den Patienten nicht mehr identifizieren! Dann tue ich ihm doch unrecht.
Weil Sie ihm Informationen vorenthalten, die der Patient vielleicht nicht wissen wollte?
Natürlich muss man den Patienten vorher fragen, wie mit Zufallsbefunden umgegangen werden soll. Was ich dagegen für nicht länger hinnehmbar halte: Bisher argumentierten Wissenschaftler, sie seien erstens keine Kliniker, und weil sie zweitens die Patienten auch nicht reidentifizieren könnten, müssten sie generell keine Zufallsbefunde mitteilen. So ist zum Beispiel vorstellbar, dass etwa Frauen mit den Brustkrebsgenen BRCA1 und BRCA2 gar nicht erfahren, dass sie eine 80- oder 90-prozentige Wahrscheinlichkeit haben, an Brustkrebs zu erkranken. Das geht natürlich nicht. Man muss sich schon im Vorfeld vernünftig und individuell mit der Frage beschäftigen, ob und wie der Patient informiert werden möchte. Gleichzeitig muss allen klar sein, was genetische Informationen wirklich können und was nicht.
Was wäre ein richtiger Umgang mit Forschungsdaten und -befunden?
Die Herangehensweisen in Europa sind unterschiedlich. Viele deutsche Projekte tendieren dazu, nur solche Probanden in Studien einzuschließen, die sich vorab einverstanden erklären, alle Befunde – auch zufällige – wissen zu wollen. In Großbritannien ist das anders. Dort werden Menschen, die Kenntnis erlangen wollen über ihre Befunde, oft erst gar nicht aufgenommen.
Und jetzt? Was wiegt schwerer? Das Recht auf Wissen oder das Recht auf Nichtwissen?
Eine sehr gute Frage, die in der wissenschaftlichen Diskussion seit über 50 Jahren gestellt wird. Ich werde sie hier und in drei knappen Sätzen sicher nicht beantworten. Je nach Projekt kann man individuell gewiss zu guten Lösungen kommen. Was wir jedoch global ändern müssen, und darum geht es mir, das ist die Art und Weise, wie wir mit Daten umgehen und wie wir mit Patienten umgehen. Wir werden künftig in allen Lebensbereichen mit immer größeren Datenmengen forschen und arbeiten. Die Geschwindigkeit wird sich ändern, mit der wir die Daten bearbeiten. Entsprechend muss sich auch unsere Denke über Daten ändern.
Können Sie das konkretisieren, was sich da verändern muss?
Wir müssen damit leben, dass die Daten da draußen sind, und dürfen nicht allzu nervös sein.
Sollen Patienten mehr Mitsprache haben?
Selbstverständlich. Politik und Gesundheitssysteme müssen sich Gedanken machen, warum wir in der Interaktion mit Patienten und Probanden immer noch in den 60er Jahren stecken. Wir machen hoch technologische, extrem teure Hochleistungsforschung, aber die Einwilligungsinformationen generieren wir wie in den 60er Jahren – über Papierformulare. Diese verschwinden dann in Schubladen und machen jede spätere Rückkopplung mit den Patienten außerordentlich schwer.
Was schlagen Sie stattdessen vor?
Probanden sind mündig. Was spricht dagegen, Informationen mit ihnen zu teilen? Das erhöht nicht nur die Datensicherheit, sondern führt auch dazu, dass Verantwortung geteilt wird.
Sicher, die Wissenschaftler sind dann fein raus. Aber was ist mit dem Patienten, der ein Datenpaket kriegt und erfährt, dass sein Risiko für Alzheimer stark erhöht ist? Oder dass er an einem Prostatakarzinom leidet, das ihm möglicherweise nie im Leben Beschwerden gemacht hätte?
Das ist ein Problem. Ganz geräuschlos können solche schweren gesellschaftlichen Fragen in der Regel nie gelöst werden. Aus Studien zu Bildgebungsverfahren im Forschungskontext wissen wir, dass diese Verfahren in Extremfällen bis zu 80 Prozent Zufallsbefunde generieren. Beim Neuroimaging sind in es der Regel 3 bis 12 Prozent, im Abdominal- und Brustbereich bis zu 30 Prozent. Und damit geraten wir in eine medizinethisch-philosophische Debatte: Ein solcher Befund kann das Leben von Menschen, die bislang als komplett gesund galten, zweifellos massiv verändern. Aber die Gegenfrage lautet: Wer dürfte entscheiden, dass die Information diese Menschen so sehr überfordert, sodass wir sie ihnen besser vorenthielten? Ich hielte es für wünschenswert, dass die großen Biobanken die Informationen sowohl dem Probanden als auch seinem Hausarzt zur Verfügung stellten. Damit wäre auch eine klinische Betreuung gewährleistet.
Werden künftig mehr Risiken denn Krankheiten behandelt?
Mit Sicherheit. Mir tut der Hausarzt leid, der vom Patienten seine Genanalyse aus den USA vorgelegt bekommt und handeln soll. Allerdings gilt: Auch bei einer Brustkrebs-Gendiagnose muss man nicht gleich das Messer schwingen wie bei Angelina Jolie. Sondern man kann auch sagen, wir wissen jetzt, dass da etwas ist, und deswegen erhöhen wir die Vorsorge. Die Entscheidung ist aber stets eine individuelle, sehr auf die Patientin bezogene Entscheidung.
Andere genetische Diagnosen eröffnen keine solchen Handlungsoptionen – sondern tragen höchstens zur Verunsicherung bei.
Ach was. Das ist sicherlich auch einfach ein Missverständnis über die Aussagekraft der meisten genetischen Daten. Ich bin überzeugt, dass wir alle in absehbarer Zeit unser komplettes Genom sequenziert bekommen, ohne dass Menschen in tiefe Krisen stürzen. Daraus wird sich ein Großteil der Antworten ergeben, die wir für unsere Gesundheitsbehandlung brauchen. Wichtig ist, dass Menschen wissen, wie genetische Informationen funktionieren, wie sie gespeichert werden, wie sie sie kontrollieren und frei entscheiden können, wer über sie wie verfügen darf. Die Qualität der gesellschaftlichen Teilhabe freilich wird künftig darunter leiden, je weniger Daten jemand von sich zur Verfügung stellt.
Haben Sie selbst Ihre Gene untersuchen lassen?
Ja. Dank des Gentests einer bekannten kalifornischen Firma weiß ich, dass ich unter anderem ein deutlich erhöhtes Risiko habe für Herzerkrankungen. Mein Risiko liegt bei 64,5 Prozent, das des Bevölkerungsdurchschnitts bei 46,8 Prozent. Gleichzeitig sagt mir der Gentest, dass ich auf einen Blutverdünner, der bei Herzbeschwerden in Notaufnahmen standardmäßig gegeben wird, genetisch bedingt keine Reaktion zeige. Sollte mir etwas passieren mit dem Herzen, könnte ich idealerweise also zumindest schauen, dass sie mir im Krankenhaus einen anderen Wirkstoff geben. Realistisch gesehen werde ich im Akutfall aber wahrscheinlich andere Sorgen haben, als den behandelnden Ärzten Vorschriften über die Medikamentengabe zu machen.
Hat das neue Wissen weitere Auswirkungen auf Ihr Leben gehabt?
Ich würde gern sagen, dass es dazu geführt hat, dass ich öfter ins Fitnessstudio gehe – aber das ist nicht der Fall.




Leser*innenkommentare
Velofisch
Die Gesundheitsdaten sind wichtige Daten, mit denen wir umgehen lernen müssen. Wo Datenschutz nicht dadurch möglich sind, dass die Daten erst gar nicht vorgehalten sind, muss Datenschutz juristisch garantiert werden. Auch Mord lässt sich nicht verhindern aber durch Strafgesetze deutlich einschränken.
Wir alle wissen, dass wir ein 100prozentiges Sterberisiko haben. Wir verdrängen dies jedoch gerne. Wenn wir dies nicht mehr verdrängen, ist es auch einfacher damit umzugehen, wenn wir dieses Risiko in auf einzlene Krankheiten und Zeiträume bezogene Teilrisiken aufsplitten können.
Smaragd
"Wir werden künftig in allen Lebensbereichen mit immer größeren Datenmengen forschen und arbeiten. Die Geschwindigkeit wird sich ändern, mit der wir die Daten bearbeiten. Entsprechend muss sich auch unsere Denke über Daten ändern. Wir müssen damit leben, dass die Daten da draußen sind, und dürfen nicht allzu nervös sein." ... "Wichtig ist, dass Menschen wissen, wie genetische Informationen funktionieren, wie sie gespeichert werden, wie sie sie kontrollieren und frei entscheiden können, wer über sie wie verfügen darf. "
Der Mann widerspricht sich selbst. Entweder die Daten sind eben draußen, egal, ob ich das will oder nicht, oder ich kann frei darüber entscheiden.
"Die Qualität der gesellschaftlichen Teilhabe freilich wird künftig darunter leiden, je weniger Daten jemand von sich zur Verfügung stellt."
Klar, ich werde dem Arbeitgeberverband gerne die Daten zur Verfügung stellen, für welche psychischen Erkrankungen ich ein erhöhtes Risiko habe. Dann verliere ich meinen jetzigen Job, bekomme nie wieder einen neuen und lebe den Rest meines Lebens von Hartz IV (oder den in der nächsten Krise entsprechend reduzierten Folgeleistungen). Das wird meine gesellschaftliche Teilhabe in jedem Fall maximieren.
Herr Hoppe, medizinische Daten sind hochsensibel! Sie widersprechen sich selbst in der Art und Weise, wie Sie darüber denken!
wxyz
Jeglicher Datenschutz endet bereits beim Tratsch im Treppenhaus. Tratschsucht ist die Mentalität der Bevölkerungsmehrheit, und damit ist bereits bewiesen, daß Datenschutz keine Sache des Gesetzes ist, sondern eine des Charakters. Per Gesetz Datenschutz erzwingen zu wollen ist gleichermaßen unsinnig, als wolle man das Atmen verbieten.
Doch ganz anders sieht es beim Verwendungszweck greifbarer Daten aus. Da gibt es erhebliche Unterschiede zwischen dem Verhalten von Durchschnittsbürgern und denen, die den einzigen Sinn des Lebens in Reichtum und Macht sehen. Doch auch hier können keine Gesetze helfen, denn diese stammen ausschließlich von denen, die zwecks Machterhalt sogar ihre eigene Mutter verkaufen würden.