Künstliche Gliedmaßen aus der Retorte: Künstlich erzeugte Rattenpfoten
Einem Forscherteam ist es gelungen, die Pfote einer Ratte wachsen zu lassen. Die Wissenschaftler sind aber auch weiterhin auf ein Spendertier angewiesen.
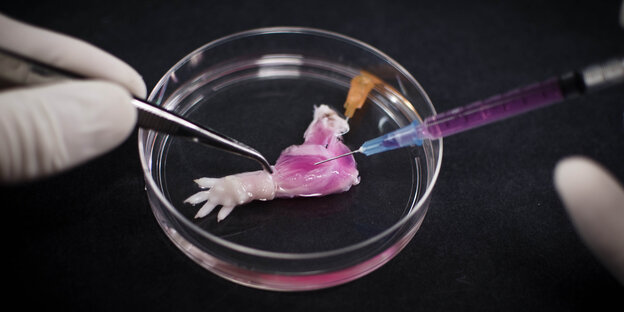
Künstliche Rattenpfote mit funtionsfähigen Gefäßen und Muskeln. Foto: Bernhard Jank/Ott LaboRatory/dpa
BOSTON dpa | Eine von einem amerikanischen Forscherteam künstlich erzeugte Rattenpfote hat Hoffnungen auf Hilfe für Menschen mit abgetrennten Gliedmaßen geweckt. „Ich hoffe, dass in vielleicht zehn Jahren Menschen einen konkreten Nutzen haben werden“, sagte Forschungsleiter Harald Ott vom Massachusetts General Hospital (MGH) in Boston. Das Team des Österreichers hatte in einem Nährmedium die Pfote wachsen lassen, die ein funktionierendes Gefäß- und Muskelgewebe habe.
„Wir haben die Pfote einer toten Ratte von allen Zellen befreit, so dass sie keinerlei Zellen mehr enthielt“, sagte Ott. „Dann haben wir sie mit lebenden Zellen quasi besiedelt.“ Das Ergebnis sei eine im Wesentlichen funktionierende Gliedmaße gewesen.
„Wir haben auch den Unterarm eines Pavians von Zellen befreit und so nachgewiesen, dass die Methode grundsätzlich auch bei Primaten angewendet werden kann.“ Ott rechnet mit einer Anwendung in der Humanmedizin in etwa zehn Jahren. „Dann wird man nicht gleich einen Unterarm wachsen lassen, aber vielleicht Muskeln.“
Die Forscher hatten mit einem Lösungsmittel in einem tagelangen Prozess alle lebenden Zellen von der amputierten Pfote einer Ratte gelöst. Nur die Grundstrukturen seien erhalten geblieben. Dann hätten sie die einzelnen Teile wieder mit lebenden Zellen eines anderen Tieres besetzt. In den folgenden Tagen seien die einzelnen Gewebe wie Muskeln und Adern wieder herangewachsen. Bei den Muskeln sei das Zellwachstum zusätzlich durch elektrische Stimulation angeregt worden. Insgesamt dauerte der Wiederbesiedlungsprozess demnach zwei Wochen.
Der große Vorteil des Verfahrens ist, dass die Immunreaktion nach einer Transplantation weit geringer ausfiele, weil das transplantierte Organ ja mit den eigenen Zellen besiedelt wurde. Funktionstests hätten gezeigt, dass die Muskeln der künstlichen Pfote auf elektrische Anregung mit Kontraktionen reagierten, erläuterten die Forscher. Ihre Kraft habe etwa 80 Prozent der von Muskeln einer neugeborenen Ratte erreicht.
Erprobte Methode
Nach der selben Methode – Entfernung aller Zellen eines Spenderorgans und Besiedelung mit lebenden Zellen – seien schon Nieren, Lebern, Herzen und Lungen von Tieren geschaffen worden. Gliedmaßen seien aber viel komplexer. In einem weiteren Versuch seien bei einem Unterarm eines Pavians alle Zellen entfernt und mit der Neubesiedlung begonnen worden, ergänzte Otts Team. Die bisherigen Ergebnisse nährten zwar die Hoffnung, so irgendwann auch beim Menschen Gliedmaßen ersetzen zu können. Der Aufbau der Nerven bleibe aber eine große Herausforderung.
Den Medizinern zufolge leben allein in den USA mehr als 1,5 Millionen Menschen mit fehlenden Gliedmaßen. Trotz großer Fortschritte bei den Prothesen sei dies eine Belastung für das tägliche Leben und nicht zuletzt das Empfinden.
„Die komplexe Natur unserer Gliedmaßen macht es zu einer großen Herausforderung, sie zu ersetzen“, so Ott. „Sie bestehen aus Muskeln, Knochen, Knorpel, Sehnen, Bändern und Nerven – alles muss aufgebaut werden und alles bedarf einer bestimmten Grundstruktur.“ Sein Team habe nun bewiesen, dass diese Struktur erhalten und mit neuem Gewebe versehen werden kann.
Methode ist nicht ganz neu
Wirklich neu sei der Ansatz nicht, sagte Raymund Horch, Direktor der Plastisch- und Handchirurgischen Klinik am Universitätsklinikum Erlangen. Eine solche Dezellularisierung und Repopularisierung sei auch schon mit anderen Geweben wie Herz und Trachea gemacht worden, habe aber bisher dennoch keinen Einzug in die klinische Anwendung gefunden.
„Es ist aber ein interessanter Ansatz, weil man letztlich doch die Natur braucht, um ein optimales Stützgerüst zu haben, welches dann durch Dezellularisieren wieder lebendig gemacht werden soll“, so Horch.
„Das eigentliche Anliegen, nämlich einmal ganze Organe zu züchten, wird damit nicht wirklich gelöst.“ Selbst wenn bei dem Ansatz künftig einmal alles gut funktionieren sollte, werde immer noch ein Spenderorgan benötigt. „Das ist aber das Problem bei der initialen Idee des Tissue Engineering gewesen: Man wollte eben gerade den Mangel an Spenderorganen umgehen.“



Leser*innenkommentare
Sagt später nicht, ihr habt es nicht gewusst
„Wir haben die Pfote einer toten Ratte von allen Zellen befreit, so dass sie keinerlei Zellen mehr enthielt“. Eine tote Ratte, soso! Wieder einmal mehr müssen Tiere (sog. "Versuchstiere") für den fraglichen Nutzen für Menschen leiden. Dem armen Lebewesen ist wohl kurz bevor es euthanasiert wurde, die Pfote ambutiert worden. Albert Schweitzer sagte einmal: "Alles was lebt, will leben." P.S.: ich selbst habe zwei zerstörte Handgelenke und bin dadurch schwerbehindert.
Monsieur Soquette
Gruslig. Frankenstein lässt grüßen....
Horst von Aquin
@Monsieur Soquette In Anbetracht Ihrer Bemerkung glaube ich, dass Sie nicht begreifen, was die Wissenschaft hier für Fortschritte leistet, um die Biologie von Lebewesen besser zu verstehen! Stellen Sie sich vor, wie vielen Menschen man heute schon besser helfen könnte, wenn die vereinigten Gesinnungsethikern nicht weiter zynische Angstszenarien verbreiten würden, wodurch die Forschung massivst gebremst wird!