Betrug mit Brustimplantaten: Mehr Kontrolle fürs Silikon
Um Medizinprodukte besser zu überwachen, müsste es ein EU-weites Gesetz geben. Nun schlagen Medizinprüfer einen Gesetzestrick für Deutschland vor.

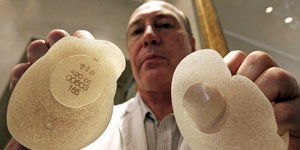
Es soll genauer nachgeschaut werden, zum Beispiel bei Brustimplantaten. Bild: dpa
BERLIN taz | Angesichts des Skandals um defekte Brustimplantate des französischen Herstellers PIP (Poly Implant Prothèse) fordert Deutschlands oberster Medizinprüfer Jürgen Windeler einen strengeren Marktzugang für sämtliche Medizinprodukte, die lebenslänglich im Körper verbleiben.
"Im Interesse der Patienten sollten die Marktzugangsvoraussetzungen für Medizinprodukte mit hoher Risikoklasse wie Herzschrittmacher, Kniegelenke, Stents oder Hüftprothesen im Grundsatz nicht anders sein als die für Arzneimittel", sagte Windeler der taz. "Das bestehende Medizinproduktegesetz hängt die Hürden niedrig und ist unbefriedigend", kritisierte der Professor für Medizinische Biometrie, der das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) leitet.
Eine Neuregelung unterliege jedoch zwingend europäischer Gesetzgebung, betonte Windeler. Angesichts der bisherigen Zurückhaltung der EU-Kommission sowie vieler nationaler Gesundheitsminister, an dem bestehenden System zu rütteln, sei er wenig optimistisch, dass sich zeitnah etwas ändern werde. Den Nationalstaaten seien die Hände gebunden, wollten sie im Alleingang die Vorschriften für Medizinprodukte verschärfen - denn deren CE-Kennzeichnung ermöglicht die EU-weite Vermarktung.
Als Ausweg aus diesem Dilemma plädiert Windeler für "eine systematische Nutzenbewertung für sämtliche Medizinprodukte, die im Körper bleiben". "Ich halte es für sinnvoll, dies im Sozialgesetzbuch V festzuschreiben", sagte er. Eine solche Gesetzesänderung kann das Parlament ohne Rücksicht auf die EU durchsetzen.
Zwar würden die Medizinprodukte damit auch weiterhin erstmal vergleichsweise lax geprüft auf den Markt gelangen. Aber: Die Hersteller wären auf diese Weise gezwungen, anschließend anhand aufwendiger Studien den patientenrelevanten Nutzen ihrer Produkte nachzuweisen. Andernfalls würden sie von der gesetzlichen Krankenversicherung nicht mehr erstattet.
Kritik am Gesundheitsminister
Die Vorsitzende des Gesundheitsausschusses im Deutschen Bundestag, Carola Reimann (SPD), und die gesundheitspolitische Sprecherin der Grünen, Birgitt Bender, unterstützen diese Initiative. "Wir werden uns im Bundestag dafür einsetzen, dass Medizinprodukte der höheren Gefahrenklasse auf diese Weise künftig strenger überwacht werden", sagte Bender der taz.
Die SPD-Politikerin Reimann kritisierte in diesem Zusammenhang den Bundesgesundheitsminister Daniel Bahr (FDP), der eine europaweite gesetzliche Verschärfung des Marktzugangs von Medizinprodukten ablehnt: "Die Lage ist desaströs. Ich verstehe nicht, warum der Minister sich verweigert", sagte sie der taz.
Zusätzlich zur Nutzenbewertung forderte Reimann die Einführung eines verpflichtenden Implantateregisters, um die Verwendung der Medizinprodukte rückverfolgen zu können. Derzeit existiert ein solches Register nur auf freiwilliger Basis.



Leser*innenkommentare
Paul Pawlowski
Gast
Als Seitentitel/Link ist bei TAZ zu lesen "Betrug-mit-Brustimplantaten". Nur im Artikel geht es nicht um den Betrug.
Wer hat denn da betrogen? Allein der französische Hersteller - oder haben Kliniken und Ärzte auch schön billig eingekauft und teuer implementiert.....
Wenstruba
Gast
Ich hab' die rettende Idee! In Zukunft nur noch Brustimplantate mit Reißverschluss einbauen, dann klappt das mit dem Silikonwechsel besser und der TÜV kann schneller prüfen, ob die Brust ausläuft oder dicht ist!!!
Ih wie eklig, wenn ein Baby am Silikon nuckelt, anstatt an der Milch. Naja, manche denken dann wahrscheinlich, schmeckt ja, wie mein Nuckel!
airbag aka DollyDollar
Gast
"Zwar würden die Medizinprodukte damit auch weiterhin erstmal vergleichsweise lax geprüft auf den Markt gelangen. Aber: Die Hersteller wären auf diese Weise gezwungen, anschließend anhand aufwendiger Studien den patientenrelevanten Nutzen ihrer Produkte nachzuweisen. Andernfalls würden sie von der gesetzlichen Krankenversicherung nicht mehr erstattet."
Womit wäre denn wohl der "patientenrelevante Nutzen" von Tittenerweiterungen gegenüber den Krankenkassen zu begründen, argumentieren, wenn der Großteil jener OPs ohnehin keinerlei Aussicht auf eine medizinische Indikation hätten, also reine Privat-sache/-obsession sind ('Schönheits'-operationen!) ?
Und wieso sollten durch einen "Gesetzestrick für Deutschland"(?) Skandale wie aktueller mit PIP verhindert werden können, wenn die meisten Titten-/etc.-OPs ohnehin im deutlich billigeren Ausland unter unvergleichbaren Standards ausgeführt werden ?!
Das Titten-Schwanz-Thema ist echtes Fetischisten-bla-bla-bla; und im Grunde handelt es sich dabei ohnehin primär um Geschäfts-Investitionen und gehört somit wohl überwiegend in die Abteilung 'Wirtschaft'.
Silly Kon
Gast
Die Frauen sind Opfer des herrschenden Medienbildes von fetten Titten, die vorgeblich sexy sein sollen. Oder selber blöd, sich unters Messer zu legen, anstatt stolz auf einen kleinen aber ästhetischen Busen zu sein.
Und was Männer angeht, die meinen, Riesenbrüste wären wichtig, liebe weiblichen Mitbürger, auf diese W.... könnt ihr locker verzichten.